ベンゼン環は何個までらせん状に縮環できるのだろうか
“One-Step Synthesis of [16]Helicene”
Angew. Chem. Int. Ed. 2015, 54, 6847–6851.
[DOI: 10.1002/anie.201502436]
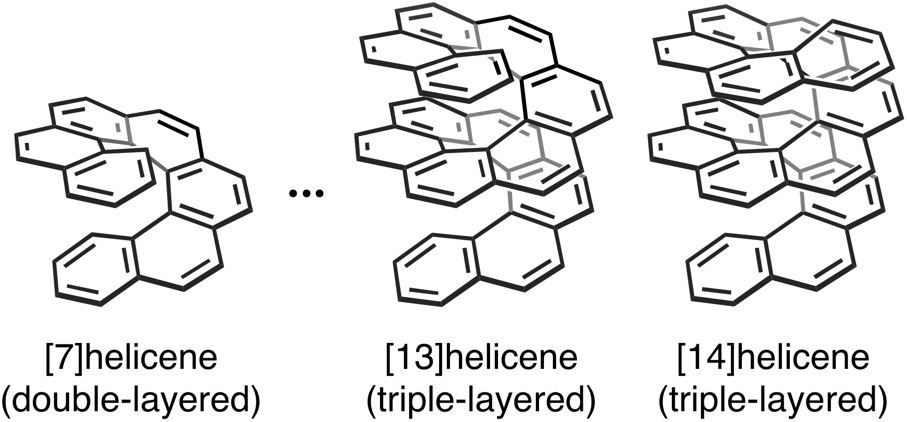
ヘリセン合成の歴史は古く、1955年のNewmanらによる[6]ヘリセンの初の合成から60年以上経過しています。私たちが研究を開始するまで最長のヘリセンは、1975年にMartinらによって合成された[14]ヘリセンであり、40年もの間、その最長の記録は更新されていませんでした。
縮環するベンゼン環の数が大きくなると、[7]ヘリセンからはベンゼン環が2層重なった構造が、[13]ヘリセンからはベンゼン環が3層重なった構造が現れます。とりわけ、3層構造になると、中央の層が上下の層から圧迫され立体的なひずみを解消しにくく、その合成が難しくなると予想されます。
[14]ヘリセンをはじめ、その多くのヘリセンは、スチルベン誘導体の酸化的光環化によって合成されてきました。例えば、[4]ヘリセンは、ナフタレン環とベンゼン環をC=C結合で連結した[2]+[1]型の前駆体から合成できます。以下同様に、縮環したn個のベンゼン環を”[n]”、C=C結合を”+”と略記して、光環化反応の前駆体の構造を示します。
![[4]Helicene formation](https://murase-lab.org/wp-content/uploads/2015/04/HP-4helicene-1024x308.jpg) ここで注目したのが、[2]+[1]型の前駆体に光を照射すると、[4]ヘリセンを位置選択的に与えることです。すなわち、「ナフタレン環とベンゼン環をC=C結合を介して連結したオリゴマーは、光照射で折り畳まれてヘリセンに変換される潜在能力を秘めている」と考えました。
ここで注目したのが、[2]+[1]型の前駆体に光を照射すると、[4]ヘリセンを位置選択的に与えることです。すなわち、「ナフタレン環とベンゼン環をC=C結合を介して連結したオリゴマーは、光照射で折り畳まれてヘリセンに変換される潜在能力を秘めている」と考えました。
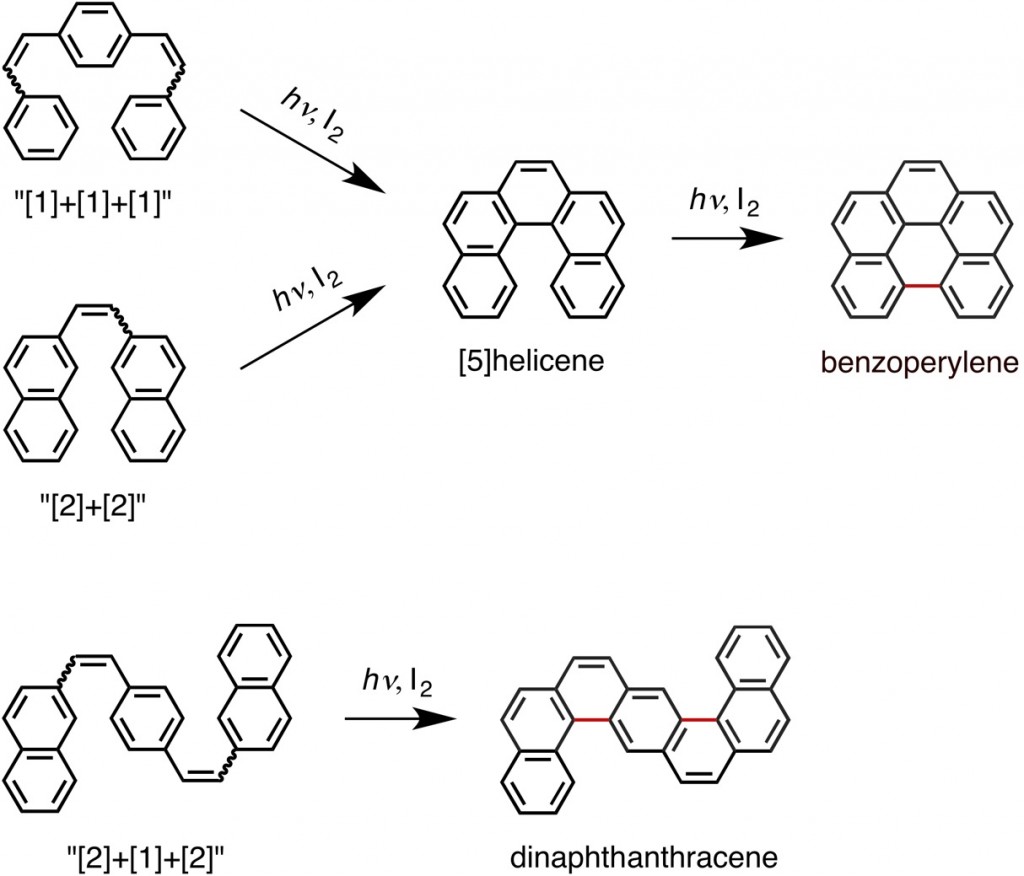
![[4]Helicene mechanism](https://murase-lab.org/wp-content/uploads/2015/04/HP-4helicene-mechanism-1024x445.jpg) しかしここでは電子的な側面しか考慮しておらず、立体的な側面を考慮していません。後述のように、[2]+[1]+[2]配列から[7]ヘリセンではなく平面状のジナフトアントラセンが優先的に生じてしまうことは、立体的な側面も考慮しなくてはいけないことを意味しています。
しかしここでは電子的な側面しか考慮しておらず、立体的な側面を考慮していません。後述のように、[2]+[1]+[2]配列から[7]ヘリセンではなく平面状のジナフトアントラセンが優先的に生じてしまうことは、立体的な側面も考慮しなくてはいけないことを意味しています。
しかし、ことはそんなに単純ではありませんでした。例えば、[2]+[2]あるいは[1]+[1]+[1]配列からは[5]ヘリセンが生じますが、これがさらに酸化されてベンゾペリレンに変換されます。また、[2]+[1]+[2]配列からは[7]ヘリセンではなく、平面状のジナフトアントラセンが優先的に生じます。
したがって、[2]と[2]の間に[1]+[1]を含む配列
···+[2]+[1]+[1]+[2]+[1]+[1]+[2]+···
をもつ前駆体のみが光照射下で生じる副生成物を最小にすることができ、一段階の酸化的光環化で高次ヘリセンに変換できると推測しました。この設計指針の妥当性は、[2]+[1]+[1]+[2]型の前駆体の酸化的光環化による[9]ヘリセン合成で実証し、従来の[9]ヘリセン合成と比較しても遜色ない収率で光環化が進行することが分かりました。
さらに、この設計指針を基にして、[2]+[1]+[1]+[2]+[1]+[1]+[2]型の前駆体から一段階の酸化的光環化で[16]ヘリセンの合成に成功しました。この前駆体にはC=C結合部位が6箇所ありますが、平均64%の効率で6回の光環化が正しく行われたことになります[(0.64)6≈0.07; 収率7%]。[16]ヘリセンの構造は最終的にX線で確認できました。(3D構造をJSmol*で表示しました。)
実際には、両末端にかさ高いTIPSO (= triisopropylsilyl ether)基を導入した前駆体を用いて光環化を行っています。光環化後、さらに3段階の変換でTIPSO基を除去し、無置換の[16]ヘリセンを得ることにも成功しています。
今回の研究成果は、最長ヘリセンの記録更新のみならず、光環化によるヘリセン合成で用いる前駆体の設計指針を与えることができたと考えています。ナフタレン環とベンゼン環をC=C結合を介して連結した単純なオリゴマーであっても、そのナフタレン環とベンゼン環を適切に配置すれば、一段階の酸化的光環化で高次ヘリセンを得ることができます。あたかも、にょろにょろと長いヘビがとぐろを巻くように。
本研究内容の詳細については こちら をご覧ください。
*ワイリー・サイエンスカフェでご紹介頂きました。
*Chem-Stationでご紹介頂きました。
*月刊誌「現代化学」2015年7月号でご紹介頂きました(p.11)。
*Synfacts 2015, 11, 718でご紹介頂きました。
本研究を進めるにあたり、ご指導、ご助言を賜りました東京大学・藤田誠教授、また、実際の合成から解析まで担当してくれた森一晋くんに感謝いたします。
*JSmol: an open-source HTML5 viewer for chemical structures in 3D. http://wiki.jmol.org/index.php/JSmol#JSmol.

![[6]Helicene](https://murase-lab.org/wp-content/uploads/2015/04/HP-6helicene.jpg)
![[9]Helicene](https://murase-lab.org/wp-content/uploads/2015/04/HP-9helicene-1024x287.jpg)
![[9]Helicene synthesis (comparison)](https://murase-lab.org/wp-content/uploads/2015/04/HP-9helicene-comparison-1024x914.jpg)
![[16]Helicene](https://murase-lab.org/wp-content/uploads/2015/04/HP-16helicene-2-1024x816.jpg)